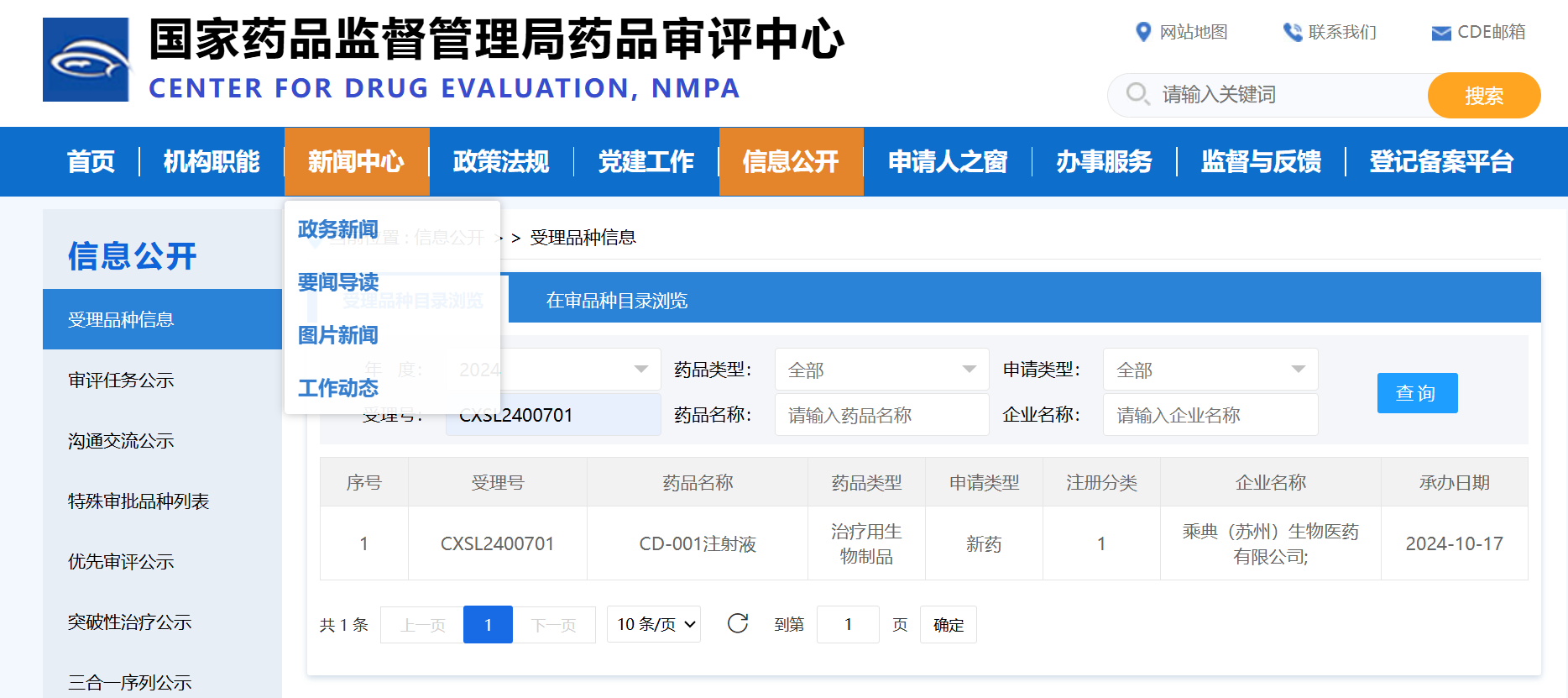
10月17日,乘典(苏州)生物医药有限公司宣布,公司首发项目CD-001在获得美国食品药品监督管理局(FDA)临床默许后又获得中国国家药品监督管理局药品审评中心(CDE)正式受理,受理号为:CXSL2400701。
公司CEO徐健博士表示,继今年9月该产品获美国FDA临床默许,成为全球第二款进入临床阶段的针对IL-21靶点的融合蛋白药物之后,我们非常高兴看到此次临床试验申请获中国国家药品监督管理局正式受理,标志着CD-001 即将成为首个国内研发的中美同时获批临床的此类产品,为全球癌症患者带来新的治疗希望。乘典生物会进一步推进新一代免疫治疗药物的研发,为全球肿瘤患者带来更多更优的治疗产品,帮助肿瘤患者获得更好更有质量的生活。
关于CD-001:
CD-001是乘典(苏州)生物针对目前临床PD-1抑制剂肿瘤治疗有效率不高的问题,自主研发的一种由抗PD-1抗体和IL-21组成的融合蛋白药物,在阻断 PD-1免疫抑制信号的同时,体内选择性扩增肿瘤反应性CD8+T细胞,可显著提高免疫治疗的疗效。在临床前研究中,CD-001在多种小鼠肿瘤模型中表现出显著的抗肿瘤治疗效果,同时在猴子毒理研究中展现了良好的安全性和药代动力学特性。目前该药物已获美国FDA的IND临床默认许可,为下一步的临床研究铺平了道路。
关于乘典:
乘典(苏州)生物是一家处于临床阶段的创新型生物技术公司,专注于解决免疫治疗领域中尚未满足的临床需求,开发新一代免疫疗法。公司首创性提出将细胞因子靶向特定免疫细胞的精准治疗策略,通过三大核心技术(ImmuX技术、FusionX技术及IME Cell技术)创建了独创的双靶融合蛋白平台。公司的研发管线覆盖多疾病领域,包含肿瘤、慢性病毒感染和自身免疫性疾病。目前,已披露的在研药物为CD-001,一种靶向性IL-21融合蛋白。
乘典生物成立于2021年4月,由资深免疫学家和具有丰富制药行业经验的资深专家组成,公司总部位于中国苏州,在北京设有分支机构。乘典生物的愿景是通过靶向特定免疫细胞,精准调控免疫反应策略,开发新一代的免疫治疗药物,最终改善和提高免疫相关疾病患者的生活质量。

